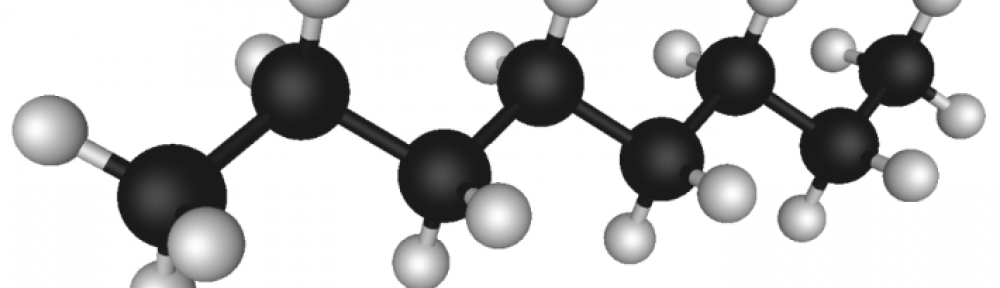
Alkani, znani tudi kot parafini. Vse vezi v molekuli so enojne kovalentne vezi, ogljikovi atomi pa tvorijo verigo, ki je linearna ali razvejana, vendar je brez zank in obročev. Alkani zato spadajo med nasičene aciklične ogljikovodike in tvorijo homologno vrsto. Sosednji členi homologne vrste se med seboj razlikujejo za eno –CH2– skupino.
Funkcionalna skupina alkanov je alkilna skupina s splošno formulo CnH2n+1–. Takšni funkcionalni skupini sta na primer metilna CH3– in etilna skupina C2H5–.
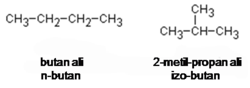
Ogljikove verige nižjih alkanov so linearne, spojine z več kot tremi ogljikovimi atomi pa lahko tvorijo tudi razvejane molekule. Pojav imenujemo skeletna izomerija:
Alkani z več kot dvema atomoma ogljika lahko tvorijo obroče s splošno formulo CnH2n in zanke – obroče, vezane na osnovno linearno ali razvejano ogljikovo verigo. Takšne alkane prištevamo k cikloalkanom. Alkane lahko torej v grobem delimo na acilkične (linearne in razvejane) alkane ter cikloalkane, ki vsebujejo obroče in zanke.
Najenostavnejši alkan je metan (CH4), sicer pa število ogljikovih atomov navzgor ni omejeno. Edina omejitev je, da je spojina sestavljena samo iz ogljika in vodika in da je nasičena, se pravi da ima samo enojne vezi.
Imenovanje
Nerazvejane alkani imajo ime sestavljeno is dveh delov. Eden pove, koliko ogljikovih atomov je v molekuli, drug pa je končnica -an, kar nam pove, da je molekula alkan.
Primer: PENTAN
- PENT – 5 ogljikovih atomov
- AN – alkan
Razvejane alkane imenujemo podobno kot nerazvejane le, da na začetku še izrazimo alkilno skupino, s katero se alkan identificira kot razvejan.
Primer: DIMETILBUTAN
- DI – 2 enaki alkilni skupini
- METIL – alkilno skupina z enim ogljikovim atomom
- BUT – 4 ogljikovi atomi v osnovnem delu molekule
- AN – alkan
Fizikalne in kemične lastnosti
Na tališče in vrelišče najbolj vpliva:
- število elektronov v ovojnici molekule; njihovo število raste s številom ogljikovih atomov.
- površina molekule, ki prav tako raste s številom ogljikovih atomov.
Pri standardnih pogojih so zato alkani od CH4 do C4H10 plinasti, od C5H12 do C17H36 tekoči, od C18H38 pa trdni.
Alkani ne prevajajo električnega toka. V električnem polju se ne polarizirajo, ne tvorijo vodikovih vezi in se zato niti ne mešajo niti raztapljajo v polarnih topilih, na primer v vodi. Alkani so torej hidrofobni.
Topnost alkanov v nepolarnih topilih je relativno dobra. To lastnost imenujemo liofilnost. Alkani se med seboj mešajo v vseh razmerjih. Gostota alkanov z naraščajočim številom ogljikovi atomov raste, vendar nikoli ne doseže gostote vode, kar pomeni, da vsi alkani plavajo na vodi.
Vsi alkani s kisikom popolnoma zgorijo v ogljikov dioksid in vodo:
- CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2
Z naraščajočim številom ogljikovih atomov se dviguje tudi temperatura vnetišča, zato se alkani z velikim številom ogljikovih atomov zelo težko vnamejo. Če je količina kisika premajhna, nastajata ogljikov monoksid in/ali saje (ogljik):
- 2CH4 + 3O2 → 2CO + 4H2O
- CH4 + O2 → C + 2H2O
V reakcijah med alkani in halogeni pride do radikalske substitucije vodika s halogenom. Halogeni lahko teoretično postopoma zamenjajo vse vodikove atome v molekuli, običajno pa nastane zmes halogeniranih produktov. Reakcija je zelo eksotermna ali celo eksplozivna.
Halogeniranje alkanov je zelo pomembenno za industrijsko pridobivanje halogeniranih ogljikovodikov. Reakcija poteka v treh stopnjah:
- Iniciacija: vezi, na primer Cl-Cl, se razcepijo (homoliza), tako nastanejo radikali Cl•. Za iniciacijo je potrebna toplotna ali svetlobna energija.
- Propagacija: radikali halogena odcepijo iz alkana odcepijo vodikove atome, tako da nastanejo alkilni radikali.
- Terminacija: iz alkilnih in halogenih radikalov nastanejo halogenirani alkani.
Poskusi so pokazali, da pri halogeniranju nastane zmes vseh možnih izomerov, to pa ne pomeni, da je zmes produktov enaka statistični zmesi. Zaradi večje stabilnosti sekundarnih in terciarnih prostih radikalov se halogeni raje vežejo na sekundarne in terciarne ogljikove atome. Značilen primer je monobromiranje propana.
Uporaba
Uporabnost alkanov je zelo natančno pogojena s številom ogljikovih atomov. Prvi štirje alkani se uporabljajo predvsem za goriva v gospodinjstvu in industriji ter za proizvodnjo električne energije v plinskih elektrarnah. Metan in etan sta glavni komponenti zemeljskega plina, ki se od nahajališč do porabnikov prevaža v plinastem stanju pod visokim pritiskom ali v tekočem stanju v ohlajenih tlačnih posodah.
Propan in butan se utekočinita pri nižjih tlakih in sobni temperaturi in sta znana kot utekočinjeni naftni plin ali gospodinjski plin. Propan se uporablja v glavnem za ogrevanje, butan tudi za polnjenje plinskih vžigalnikov za enkratno uporabo, oba pa kot potisni plin v pršilih.
Alkani od pentana do oktana so lahko hlapne tekočine – bencini – in se uporabljajo kot pogonska goriva v motorjih z notranjim zgorevanjem. Razvejani izomeri so bolj zaželeni kot linearni, ker so bolj odporni na samovžig pri povečanem tlaku, ki povzroča klenkanje motorja. Nagnjenje k samovžigu se meri z oktanskim številom goriva. Bencini so tudi pomembna industrijska nepolarna topila.
Alkani od nonana (C9H18) do heksadekana (C16H34) so tekočine z visokimi vrelišči ter večjo viskoznostjo kot bencini in niso primerni za pogon bencinskih motorjev. Uporabljajo se v glavnem kot dizelska in letalska goriva (kerozin). Kakovost dizelskih goriv se meri s cetanskim številom (cetan je staro ime za heksadekan). Zaradi višjih tališč se njihova viskoznost pri nizkih temperaturah tako poveča, da pozimi v polarnih področjih povzroča težave.
Alkani od heksadekana navzgor so pomembna sestavina kurilnega olja in mineralnih olj, ki se uporabljajo kot maziva. Maziva imajo tudi antikorozivno delovanje, ker so hidrofobna, tako da voda ne more priti v neposreden stik s kovinskimi površinami. Trdni alkani so parafinski voski, ki jih ne smemo zamenjati s pravimi voski, ki so pretežno estri višjih mastnih kislin. Parafinski voski se uporabljajo za izdelavo sveč.
Alkani s 35 ali več ogljikovimi atomi so sestavine bitumnov in se uporabljajo za asfaltiranje cest. Alkani z velikim številom ogljikovih atomov imajo majhno tržno vrednost, zato se s krekiranjem pretvarjajo v bolj uporabne alkane z manjšim številom ogljikovih atomov.
Alkanom so podobni nekateri sintetični polimeri s sto do tisoč ogljikovimi atomi, na primer polieten (polietilen) in polipropen (polipropilen). Takšni polimeri so vsestransko uporabni, zato njihova letna proizvodnja znaša več milijonov ton.
Video alkana, ko gori:
(ง ͠° ͟ل͜ ͡°)ง